به گزارش «سرویس دام، طیور و آبزیان» «ماکی دام - پایگاه خبری صنعت دام، طیور و آبزیان»؛ لپتین پروتئینی با 146 اسید آمینه و 16 کیلو دالتون جرم مولکولی است که بطور عمده توسط بافت چربی سفید تولید میشود. لپتین عمدتاً در بافت چربی سفید و از 167 اسید آمینه ساخته شده و پس از جدا شدن 21 اسیدآمینه در داخل میکروزومها با طول 146 اسیدآمینه به داخل خون رها میشود. ارتباط مثبت بسیار قوی بینmRNA لپتین و سطوح پروتئین لپتین در بافت چربی و مقادیر لپتین خون وجود دارد. از آنجائیکه لپتین در مقادیر قابل توجه ذخیره نمیشود به نظر میرسد که ترشح آن به طور پیوسته انجام میگیرد.
اثرات لپتین در سیستمهای مختلف دربرگیرنده مسیرهایی است که اشتها، مصرف انرژی و ترشح هورمونهای تولیدمثلی و متابولیکی را تنظیم میکنند. تارتاگلیا (1997) برای اولین بار گیرنده لپتین (Ob-R) را از موش به عنوان محصول ژن دیابت (db) جدا کرد. گیرنده لپتین واجد 6 ایزومر مختلف میباشد که عبارتند از: Ob-Ra, Ob/Rb, Ob/Rc, Ob/Rd, Ob/Re , Ob/Rf.
تنها ایزوفرم Ob/Rbدارای بخش داخل سلولی طویل بوده و اجزاء لازم را جهت فعال ساختن سیگنالهای داخل سلولی دارا میباشد، از این رو به عنوان ایزوفرم عملکردی 8 یا شکل بلند 9 شناخته میشود. مسیر JAK2/STAT مهمترین مکانیسم داخل سلولی لپتین میباشد. با این وجود، مسیرهای PI-3K و MAPKنیز در انتقال سیگنال دخیل میباشند.
لپتین به عنوان اندیکاتور ذخایر انرژی بوده و واسطه بالانس انرژی میباشد. لپتین با کاهش اشتها و افزایش تولید گرما از چاقی ممانعت مینماید. اما با توجه به این نکته که میزان لپتین در پاسخ به وعدههای غذایی افزایش نمییابد، بعید به نطر میرسد که به عنوان سیگنال سیری در کوتاه مدت عمل نماید. نقش لپتین در تنظیم وزن بدن ممکن است با سیگنالهای متابولیکی دیگر نظیر انسولین و گلوکوکورتیکوئیدها همراه باشد.
با توجه به نقشهای متنوعی که به لپتین نسبت داده میشود میتوان اندامهای هدف مختلفی برای آن تصور نمود. به عنوان مثال، mRNA گیرنده عملکردی لپتین در بافتهای چربی، عضله اسکلتی، کبد، کلیه، بیضه، دئودنوم، هیپوتالاموس و هیپوفیز گاو ردیابی شده است. لذا با توجه به اهمیت هورمون لپتین در متابولیسم و از آنجائی که کبد به عنوان یک اندام موثر و مرکزی در متابولیسم بدن دخیل است لذا مطالعه اخیر با هدف بررسی وجود یا عدم وجود گیرنده عملکردی لپتین در کبد گوسفند انجام شد تا مشخص شود آیا کبد گوسفند به عنوان یکی از اندامهای هدف هورمون لپتین میباشد.
مواد و روش کار
برای جمعآوری نمونههای بافتی، با مراجعه به کشتارگاه صنعتی مشهد بلافاصله پس از ذبح گوسفند نمونه کبد اخذ گردید. نمونهها در کنار یخ به آزمایشگاه منتقل شده و پس از خرد نمودن حدود 50 میلیگرم بافت به لولههای 1.5 میلیلیتری اپندورف منتقل گردید.
نمونهها در فریزر 80- درجه سانتیگراد تا زمان استخراج RNA نگهداری شدند. استخراج RNA با استفاده از محلول (Roche) TRizol و بر اساس دستورالعمل شرکت سازنده انجام شد. در مرحله پایانی جداسازی RNA، پلت RNA با 50 میکرولیتر آب RNase free آغشته به دی اتیل پیروکربنات گرم شده (60-55 درجه سانتیگراد) حل گردید.
به منظور حذف DNA ژنومی، از آنزیم دزوکسی ریبونوکلئاز I (DNase I) عاری از RNase استفاده شد. در مرحله بعد، واکنش رونوشت برداری معکوس برای تهیه cDNA با استفاده از 18(dT) Oligo و آنزیم رونوشت برداری معکوس (-M MULV) انجام گردید.
جفت پرایمرهای (Forward و Reverse) اختصاصی ژنهای بتااکتین (ژن کنترل) و گیرنده لپتین بر اساس اطلاعات توالی موجود در بانک ژن طراحی شدند. پرایمرهای بتااکتین بر روی دو اگزون متفاوت طراحی گردیدند تا باند حاصل از تکثیر cDNA و DNAمتفاوت از یکدیگر باشد. در این صورت امکان آلودگی نمونههای DNA با cDNA ژنومی قابل تشخیص بود. نتایج حاصل از تکثیر cDNA بتااکتین قطعه 277 جفت بازی، و حاصل از تکثیر DNA بتااکتین 366 جفت بازی بود. واکنش زنجیرهای پلیمراز با استفاد از پرایمرهای طراحی شده و در حجم نهایی 25 میکرولیتر در طی 40 سیکل و با شرایط دمایی مناسب (5 دقیقه با دمای 95 درجه سانتیگراد جهت واسرشت، 45 ثانیه با با دمای 66 درجه سانتیگراد برای بتااکتین و 55/5 درجه سانتیگراد برای گیرنده لپتین جهت اتصال آغازگر به قسمت مکمل در الگو، 45 ثانیه با دمای 72 درجه سانتیگراد جهت طویل شدن آغازگرها و در پایان 10 دقیقه با دمای 72 درجه سانتیگراد جهت طویل شدن رشتههای جدید) در دستگاه ترموسیکلر انجام شد.
محصولات واکنش PCR بر روی ژل آگارز 1/5درصد با استفاده از تانک الکتروفورز تفکیک شده و با استفاده از دوربین در زیر اشعه فراء بنفش قابل رویت گردیدند. باندهای بدست آمده با باند مارکر استفاده شده در ژل الکتروفورز مقایسه شد تا اندازه باندها مشخص شود.
نتایج و بحث
با استفاده از mRNA بتااکتین، به عنوان یک (Housekeeping gene) ژنی که همیشه فعال بوده و در شرایط مختلف به
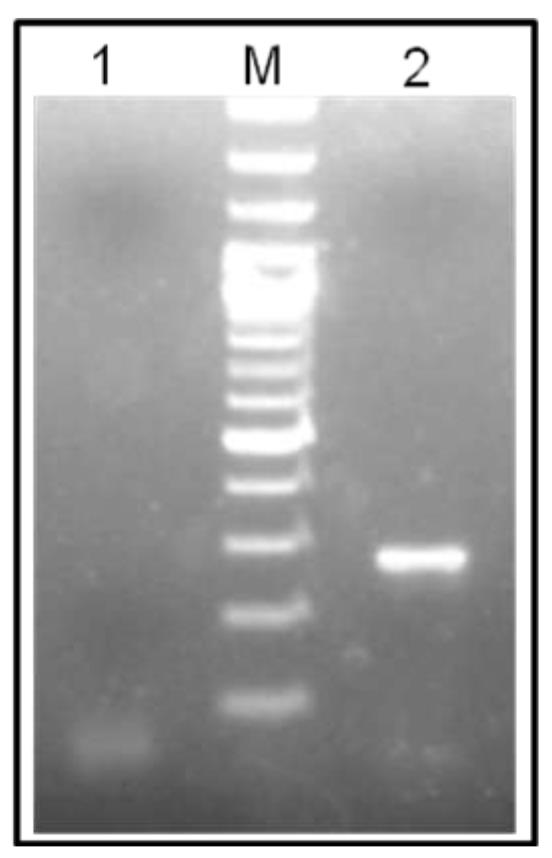
شکل 1- الکتروفورز قطعه حاصل از تکثیر cDNA بتااکتین (722 جفت بازی) بافت کبد. کبد مارکر 100M (خط2)، کنترل منفی (خط 2). جفت بازی DNA
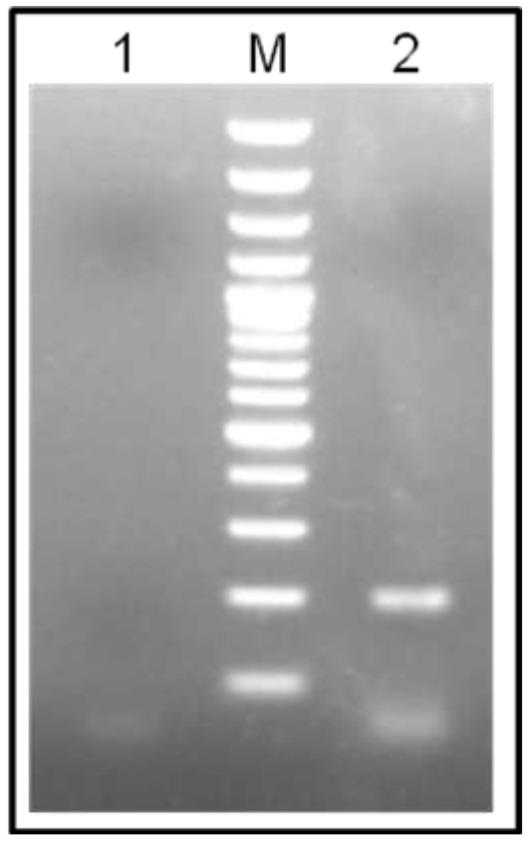
شکل 2- بیان گیرنده عملکردی لپتین mRNA استخراج شده از بافت کبد با RNA از الکتروفورزRT-PCR استفاده از واکنش گیرنده لپتین (197 جفت cDNA قطعه بازی) تکثیر شده از بافت کبد (خط2) مارکر 100 جفت M کنترل منفی (خط1)
یک میزان بیان میشود، وضعیت کمی و کیفی RNAهای استخراج شده مورد ارزیابی قرار گرفت و پس از مشخص شدن وضعیت مطلوب کیفی و کمی RNA، واکنش PCR RT-PCR با استفاده از پرایمرهای مخصوص گیرنده لپتین انجام شد.
اگرچه جهت حذف آلودگی ژنومیدر نمونههای RNA استخراج شده از آنزیم DNase I استفاده میشد، لیکن به منظور اطمینان بیشتر پرایمر بتا اکتین بر روی دو اگزون متفاوت طراحی گردید تا تکثیر از روی DNA نسبت به cDNA قطعه بزرگتری را تولید نماید. (دادهها نشان داده نشده). انجام واکنش RT-PCR با استفاده از پرایمرهای بتا اکتین cDNA سنتز شده از نمونه منجر به پدیدار شدن قطعه 277 جفت بازی گردید (شکل 1). این یافته به همراه عدم تکثیر قطعه 366 جفت بازی، نشانگر نبود آلودگی ژنومی در نمونههای RNA و همچنین کیفیت و کمیت مناسب RNA برای انجام مرحله بعد یعنی ردیابی mRNA گیرنده لپتین بود.
در مرحله بعد واکنش زنجیرهای پلیمراز با استفاده از پرایمر اختصاصی گیرنده لپتین انجام شد و آنالیز محصولات تکثیر شده بیان mRNA آن در کبد گوسفند را هماهنگ با مطالعه انجام شده در گاو تایید کرد.
(شکل 2). حال با توجه به بیان گیرنده لپتین در بافت کبد گوسفند، بایستی نقشهای پاراکرینی/اتوکرینی آن در فیزیولوژی کبد گوسفند و اثرات متابولیسمی آن درتحقیقات آتی مورد توجه قرار گیرد.
منبع: هفدهمین کنگره دامپزشکی ایران، اردیبهشت 1391
نویسندگان:عباس ابویسانی ، حسام دهقانی: استادیار و دانشیار بخش فیزیولوژی، گروه علوم پایه، دانشکده دامپزشکی و عضو پژوهشکده بیوتکنولوژی، دانشگاه فردوسی مشهد، مشهد، ایران.
مرتضی زاهدی: دانشجوی کارشناسی ارشد فیزیولوژی، گروه علوم پایه، دانشکده دامپزشکی، دانشگاه فردوسی مشهد، مشهد، ایران.