به گزارش «سرویس دام، طیور و آبزیان» «ماکی دام - پایگاه خبری صنعت دام، طیور و آبزیان»؛ جهت دستیابی به تشخیص صحیح و دقیق، نمونهها باید هم بهصورت صحیح انتخاب شده و هم میبایست در زمان دقیقی این کار انجام شود و بهصورت صحیح نیز حمل شود. چه بسا بافتهای مناسب جمعآوری شده که در اثر عدم رعایت زمان نمونهگیری و طریقه حمل نمونه، ارزش تشخیصی خود را ازدست بدهند.
نمونهها باید بهصورت صحیح، ثبت مشخصات شده و در درجه حرارت مناسب هرچه سریعتر به آزمایشگاه تشخیصی ارسال شوند.
از آنجا که اکثریت عوامل سقط جنین دامها، میکروبهای بیماریزا برای انسان میباشند باید دقت کافی در بستهبندی نمونهها صورت گیرد تا هیچگونه نشت موادی از جعبه حمل نمونه صورت نگیرد، همچنین میبایست میزان کافی از کیسههای یخ جهت پائین نگه داشتن دمای محیط در کنار نمونهها قرار گیرد.
کلمات «نمونههای بیولوژیک، شکستنی و حمل با احتیاط» میبایست بر روی جعبهها بهصورت بزرگ و قابل مشاهده نوشته شود.
جفت
زمانی که جفت جنینهای سقط شده در دسترس باشد و زیاد با خاک و بستر آلوده نشده باشد، بهترین نمونه برای تعیین یا جداسازی بسیاری از عوامل سقط میباشد. علاوه بر امکان تهیه کشت میکروبی مناسب از جفت، میتوان برای تهیه مقاطع پاتولوژی و همچنین تهیه گسترش و رنگآمیزی از آن استفاده کرد.
در زمانی که امکان انتقال جفت به هر دلیل به آزمایشگاه وجود ندارد لازم است تعدادی کوتیلودون جدا شده و ارسال گردد. جهت انجام این کار باید تعداد حداقل 6-7 کوتیلودون همراه با پردههای بین کوتیلودونی جدا شده و در ظرف استریل به آزمایشگاه ارسال شود.
باید دقت داشت که کوتیلودونهایی که دارای جراحات قابل مشاهده هستند حتماً جدا و ارسال شوند.
اگر کوتیلودونها با خاک آغشته شدهاند میتوان قبل از ارسال، آنها را با استفاده از مقداری سرم فیزیولوژی استریل شستشو داد. برای مقاصد مختلف لازم است تا کوتیلودونها به روشهای زیر ارسال شوند:
• جهت بررسیهای ویروسی لازم است کوتیلودونها در محیط انتقال ویروسی (Viral transport medium) حمل شوند.
• بهمنظور جدا سازی کمپیلوباکتر، کوتیلودونها باید در محیط FPB/glycerol حمل شوند.
• برای بررسی لپتوسپیراها کوتیلودونها باید در 100 سی سی محلول 1% آلبومین سرم گاوی (BSA) منتقل شوند.
• جهت بررسیهای هیستوپاتولوژی، تکههای نیم سانتیمتری از کوتیلودونهایی که جراحت دارند جدا شوند و در محلول فرمالین 10% به آزمایشگاه ارسال شوند. باید دقت داشت که 1 قسمت نمونه به ازاء 10 قسمت محلول فرمالین وجود داشته باشد.
• برای تهیه گسترشهای باکتریایی لازم است تا از کوتیلودونهای با جراحت مشخص بر روی لامها انتقال داده شود.
نمونه سوآب واژن
ترشحات دستگاه تناسلی بلافاصله بعد از سقط که با استفاده از سوآب واژنی جمع میشود یکی از بهترین نمونهها برای تعیین عامل سقط میباشد. این ترشحات به اندازه کوتیلودونها از غلظت میکروارگانیسم مولد سقط برخوردار نیست اما به میزان قابل توجهی بیانگر آلودگی جفت میباشد.
سوآب واژن از یک طرف نمونه بسیار خوبی جهت آزمایشات باکتریشناسی بوده و از طرف دیگر خطر کمتری برای نمونهگیر و انتقالدهنده دارد. لازم است که نمونه با فاصله کمی بعد از سقط جنین از دام گرفته شود.
ترشحات دستگاه تناسلی معمولا به مقدار بسیار زیادی در روزهای اولیه بعد از سقط وجود دارد که به سرعت از میزان آن کم شده یا دفع آن متناوب خواهد شد، درنتیجه اگر در روزهای اولیه بعد از سقط و یا به میزان کافی اخذ نشوند، میتواند آزمایشات ما را غیرقابل اعتماد کند.
یکی از نکات مهمی که باید به آن توجه شود این است که از سوآبهایی استفاده شود که طول بلندی داشته باشند.
این توصیه جهت جلوگیری از ایجاد آلودگیهای ثانویه میباشد، چراکه اگر در این امر دقت کافی صورت نگیرد و سوآبها با احتیاط جمعآوری نشوند، ممکن است در اثر تماس سوآب با پوست حیوان یا محیط، باکتریهایی در کشت میکروبی جدا شوند که در تشخیص، گمراهکننده باشند.
نمونه بافت جنینهای سقط شده یا نوزادان تازه مرده
بافتها اعم از کبد، کلیه، طحال، مغز و... میبایست بهصورت سترون و حتیالمقدور بلافاصله بعد از سقط یا مرگ از جنین اخذ شود. نمونهها باید:
• در ظرفهای استریل حمل و نگهداری شوند.
• همانند آنچه در مورد جفت گفته شد، در محیطهای انتقال اختصاصی بر حسب عامل مورد نظر حمل شوند.
• در ظروف شیشهای با حجم 10 برابر فرمالین 10% برای آزمایشات هیستوپاتولوژی حمل شوند.
• زمانی که زیاد اتولیز نشده باشد باید مغز بهصورت کامل از جنین جدا و ارسال شود.
مایعاتی که باید از جنین سقط شده اخذ شود:
محتویات معدهها خصوصا شیردان، خون قلب، مایعات حفره بطنی و قفسه سینه در صورتی که جنین اتولیز نشده باشد، میتوانند بهعنوان نمونه اخذ شوند. این مایعات میبایست بلافاصله و در کمترین زمان بعد از سقط بهصورت استریل اخذ شوند.
شیر
نمونه شیر یا آغوز باید از همه کارتیهها در ظرفهای استریل اخذ شود. لازم است قبل از نمونهگیری، کارتیهها ضدعفونی شوند، چند دوشش اولیه دور ریخته شده و از دوششهای بعدی نمونه موردنظر اخذ شود.
این نمونهها میتوانند جهت تشخیص پادتن یا پادگن موردنظر مفید باشد. نمونههای شیر را نباید منجمد یا گرم کرد، همچنین این نمونهها نباید در معرض تکان شدید قرار گیرند. درصورت ضرورت میتوان جهت انجام آزمونهای باکتریشناسی، شیر را منجمد نمود.
خون
نمونه خون از دامهای سقط کرده در زمان سقط، بهترین نمونه برای جداسازی عامل بیماری میباشد. در بیشتر موارد اخذ نمونه خون در پستانداران از ورید اجوف و ورید دمی است، البته از ورید بازویی و پستانی نیز میتوان استفاده کرد.
برای برداشت نمونه خون، میتوان از سرنگ و سوزن یا لوله خلأ و سوزن استفاده کرد. بهتر است پوست محلی که میخواهید نمونه خون را اخذ کنید را تراشیده و با الکل 70 % ضدعفونی کنید و بگذارید خشک شود.
همچنین ممکن است تهیه گسترش ضخیم یا نازک از خون ضرورت یابد.
دو نمونه باید از دام اخذ شود:
1- یک لوله بدون ضد لخته (لوله معمولی) برای جدا شدن سرم از خون و ردیابی پادتن در سرم
2- یک لوله آغشته به هپارین که مانع از لخته شدن خون شود، به منظور جداسازی میکروارگانیسم عامل.
لازم است از تمام دامهای سقط کرده و حداقل 10% دامهای آبستن خونگیری به عمل آمده و پلاکگذاری شوند.
دو تا سه هفته بعد باید مجدداً از دامهای قبلی نمونه سرم تهیه گردد تا هرگونه کاهش یا افزایش عیار پادتن در آن سنجیده شود. عیار افزایش یابنده یکی از بهترین شاهدها برای تشخیص میکروارگانیسم مولد بیماری میباشد.
میزان عیار پادتن ممکن است بسته به میکروارگانیسم مولد بیماری و یا تکنیکی که جهت تشخیص به کار برده میشود، سریعاً کاهش یابد. بنابراین لازم است نمونههای سرم کمتر از گذشت 8 هفته از سقط یا زایمان از دامها اخذ شود.
اگر نمونهها بعد از این زمان تهیه شود، در موارد بسیاری، قادر به تفریق پادتنهای ناشی از یک عفونت مزمن یا مایهکوبی اخیر و یا عفونت اخیر با عامل مولد سقط، نمیباشیم.
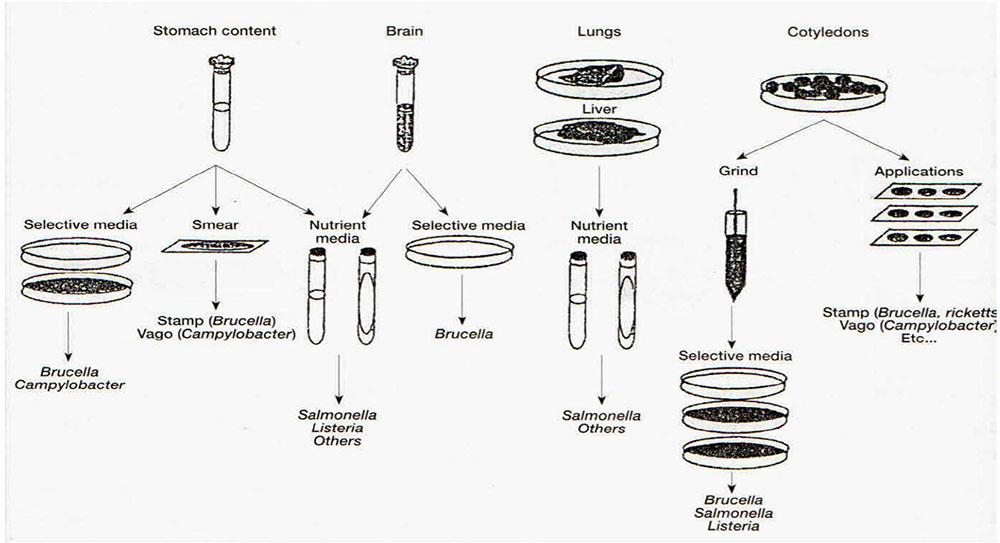
تصویر شماره 1- تشخیص مستقیم سقطهای عفونی. آنالیز نمونهها
روش جمعآوری، بستهبندی و ارسال نمونه
جمعآوری نمونهها
1- خون کامل را در دو لوله فاقد ماده ضد انعقاد و حاوی EDTA جمعآوری کنید. (از سوزنی که بهوسیله آن نمونه خون را جمعآوری کردهاید مجدداً استفاده نکنید و آن را دور بیندازید (برای انجام آزمون PCR بهتر است از EDTA استفاده شود.
2- جنین را بهدقت معاینه کنید تا بتوانید موارد غیرطبیعی را درصورت وجود، مشاهده کنید (این ناهنجاریها میتواند در اندامها، سر و... وجود داشته باشد) و درصورت مشاهده موردی، آن را در برگه تاریخچه سقط گزارش کنید. به دقت پوست و بخصوص اطراف سر و پلک را معاینه کنید.
3- از یک چاقوی تمیز استفاده کنید. محوطه بطنی و قفسه سینه جنین را باز کنید، به زخمها (بخصوص در کبد و ریه) توجه کنید.
4- نمونههای تازه جنین را با روشهای زیر جمعآوری کنید:
1-4) پوست: ¼ - ½ پوست گوش. آن را در یک ویال پلاستیکی با درب غیرقابل نفوذ قرار دهید.
2-4) ریه: درصورت امکان، نمونهای با ابعاد 2×3 تهیه کنید. آن را در کیسههای نفوذناپذیر قرار دهید.
3-4) غده فوق کلیه: غده فوق کلیه را بطور کامل ارسال کنید. آن را در کیسههای نفوذناپذیر قرار دهید.
4-4) کلیه: اگر کلیه خیلی بزرگ نیست، آن را بطور کامل ارسال کنید. اگر نه، یک قسمت بزرگ با ابعاد 1×2 کافی است. آن را در کیسههای نفوذناپذیر قرار دهید.
5-4) جفت: نمونه ای با ابعاد 2×3 سانتیمتر برداشت کنید (درصورت امکان، برداشت نمونه از قسمتی باشد که در معرض محیط خارج قرار نگرفته باشد). آن را در کیسههای نفوذناپذیر قرار دهید.
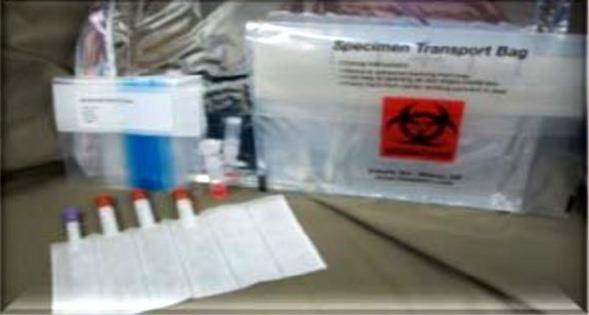
تصویر شماره 2- ظروف نمونهگیری و بسته بندی آنها
5- خون قلب را جمعآوری کنید، برای این کار از سرنگ 5 میلیلیتری و سوزن G1 ½ in. 18 استفاده کنید. بهتر است 3-10 میلیلیتر از خون قلب جنین را جمعآوری کنید. گاهی لازم است که بطن چپ را برش دهید و خون را از سطح آن بیرون بکشید (اگر خون در دسترس نباشد میتوانید از مایعات جنب و صفاق استفاده کنید).
خونی را که جمعآوری کردهاید، در داخل لوله فاقد ضد انعقاد بریزید (سرنگ و سوزن استفاده شده را دور انداخته و آن را مجدداً وارد کیت نکنید.)
6- محتویات محوطه بطنی را جمعآوری کنید. با استفاده از سوآب آغشته به الکل، سطح شکم را ضدعفونی کنید. با استفاده از سوزن و سرنگ 5 میلیلیتری، محتویات شیردان را جمعآوری کنید و آن را داخل لوله فاقد ماده ضد انعقاد بریزید (سرنگ و سوزن استفاده شده را دور انداخته و آن را مجدداً وارد کیت نکنید.)
نحوه بستهبندی نمونهها:
لولههای محتوی نمونه خون، محتویات معده و ویال نمونههای پوست را در جایگاه مخصوص خود در داخل کیسه جاذب قرار دهید. سپس آن را بستهبندی کنید و داخل کیسههای نفوذناپذیر قرار دهید.
کیسههایی که حاوی بافتهای تازه هستند را در یک کیسه نفوذناپذیر بزرگتر قرار دهید و آن را داخل کیسه نمونه بگذارید. کیسه را طبق دستورالعمل گفته شده بستهبندی کنید. سپس آن را داخل کیسه عایق به همراه دو بسته یخ قرار داده و بستهها را ارسال کنید.
نمونههای ثابت شده
7- جهت انجام آزمایشهای هیستوپاتولوژی، برشهایی به ضخامت 1 سانتیمتر از هریک از بافتهای زیر تهیه کنید و آنها را در ظرف کوچک محتوی فرمالین قرار دهید.
1-7) جفت (کوتیلودونها از سه ناحیه و هر قسمتی که غیرطبیعی باشد)
2-7) کبد
3-7) ریه
4-7) غده فوق کلیه
5-7) قلب
6-7) تیموس
7-7) روده باریک
8-7) کلیه
9-7) پوست
10-7) هر بافت دیگری که احتمال میدهید برای نمونهگیری مناسب باشد
8- کل مغز را خارج کنید، حتی اگر دچار هضم خود به خودی (اتولیز) شده باشد و آن را در ظرف بزرگ فرمالین قرار دهید. بافت انتخابی جهت تشخیص سقطهای ناشی از تک یاختهها (همچون نئوسپورا) مغزثابت شده است.
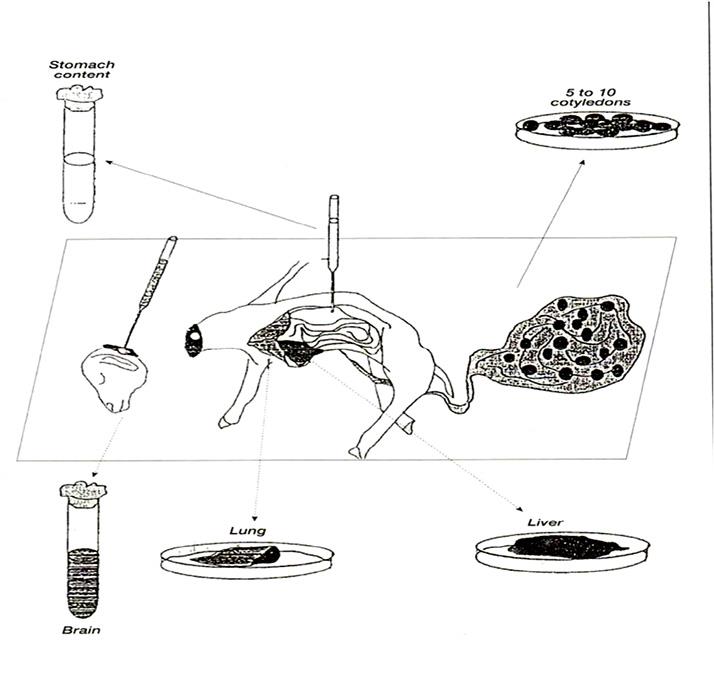
تصویر شماره 3- تشخیص باکتریشناسی سقط عفونی. جمعآوری نمونهها
بستهبندی و ارسال نمونهها
1- کیسه عایقی که نمونهها را در داخل آن قرار دادهاید و همینطور کیف حاوی ظروف فرمالین را داخل جعبه کیت قرار دهید.
2- برگه عمومی ارسال نمونه و برگه تاریخچه سقط را کامل کنید. سپس فرمها را داخل کیسه نفوذناپذیر بازگردانده و آنها را در قسمت پشتی جعبه قرار دهید.
3- جعبه را ببندید و آن را بستهبندی کنید.
4- برچسب پستی را در قسمت خارجی جعبه قرار دهید.
5- نمونهها را برای انجام آزمایش ارسال کنید.
فراهم نمودن نمونههای ثابت شده: هر دو شیشه فرمالین را همراه با کاغذ جاذب داخل کیسه نفوذناپذیر قرار دهید.
14 روز بعد، دومین نمونه سرم مادری را جمعآوری کنید (فقط از خون نمونهگیری کنید) و آن را بصورت جداگانه ارسال کنید. در برگه ارسال نمونه، باید تأکید شود که نمونههای ارسالی، دومین نمونه سرمی هستند. توجه داشته باشید که نمونهگیریهای متوالی، هزینههای اضافی را نیز دربر دارد.
وسایل لازم جهت جمع آوری نمونهها
1 کیسه عایق
2 بسته منجمد شده
1 کیسه نمونه
2 ظرف پلاستیکی فرمالین (یکی کوچک و یکی بزرگتر)
4 کیسه نفوذناپذیر با اندازه متوسط
مواد جاذب (6 کیسه نمک، ورقهای کوچک و ورقهای بزرگتر)
3 لوله فاقد ماده ضد انعقاد برای جمعآوری خون
1 لوله حاوی EDTA برای جمعآوری خون
1 سوزن برای جمعآوری خون (20 G1 ½ in.)
1 ویال پلاستیکی با درب اسنپ محتوی بافر فسفات سالین
2 سرنگ 5 سیسی (بدون سوزن)
1 اسکالپل
2 سوآب الکل
4 کیسه نفوذناپذیر کوچک برای قرار دادن نمونههای ریه، غده فوق کلیه، کلیه و جفت
1 کیسه نفوذناپذیر با ابعاد 12×10 (برای نوشتن توضیحات لازم در مورد نمونه ارسالی)
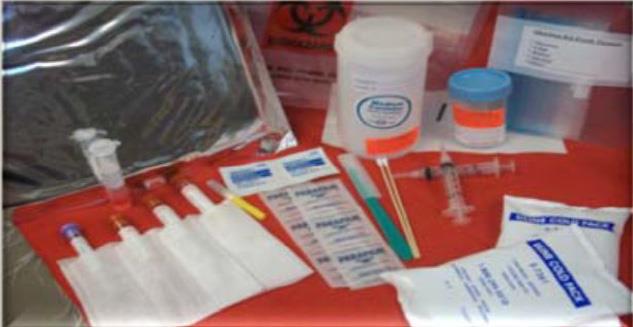
تصویرشماره 4 - وسایل لازم جهت جمع آوری نمونهها
برگههایی که باید با نمونه ارسالی، جهت توضیحات لازم همراه باشد
برگه عمومی ارسال نمونه
برگه دستورالعمل
برگه اخذ سابقه سقط/ مشکلات تولیدمثلی
جمع آوری، بستهبندی و انتقال نمونههای ویروسی به آزمایشگاه
نمونهگیری بایستی از محل مناسب و در زمان مناسبی انجام شود. بهترین زمان نمونهگیری، تا حد ممکن بلافاصله پس از بروز علائم درمانگاهی بیماری است یعنی زمانی که بالاترین میزان جرم در بدن موجود است.
گاهی چند روز پس از شروع علائم، این دوره بهسرعت تمام میشود. در صورتیکه چند روز یا چند هفته پس از مصرف آنتیبیوتیک، درمان به شکست منتهی شده باشد نمونهگیری بیفایده خواهد بود.
محل نمونهگیری بستگی به علائم درمانگاهی و بیماریزایی جرم دارد. پس از جمعآوری، نمونهها را برچسب زده و همراه با نوشتن تاریخچهای از تشخیص اولیه، به آزمایشگاه ارسال میکنند.
در مناطقی که هوا معتدل بوده و زمان ارسال نمونهها به آزمایشگاه کمتر از یک روز طول میکشد، معمولاً از جعبههای چوب پنبهای همراه با یخ (4 درجه سانتیگراد) استفاده میشود.
اگر هوا گرم بوده و زمان رسیدن نمونه به آزمایشگاه بیش از یک روز طول میکشد، میتوان از یخ خشک (70 - درجه سانتیگراد) استفاده کرد با این حال بهتر است در هنگام ارسال، جعبه حاوی نمونه را توسط یخ مرطوب دوباره پر کرد.
درصورت مشکوک بودن به جرمهای غیربومی و یا جرمهای عامل بیماری مشترک در نمونههای ارسالی، باید جعبههای چوب پنبه حاوی نمونه را در مخازن دو جداره محکم به همراه پوشال جاذب قرار داد.